La cytoponction thyroïdienne écho-guidée demeure à l’heure actuelle la meilleure méthode de dépistage du cancer de la thyroïde avec une grande sensibilité. Ces dix dernières années, les progrès techniques et l’utilisation d’une terminologie consensuelle ont permis de conserver et d’optimiser ses performances diagnostiques.
L’utilisation de la technique de cytologie en milieu liquide permet une analyse morphologique aussi performante que la cytologie conventionnelle avec des avantages supérieurs :
– Substance hémolytique éliminant le caractère hémorragique des ponctions, cause fréquente du caractère non diagnostique
– Rinçage de l’aiguille permettant de recueillir la quasi-totalité du matériel ponctionné
– Utilisation possible de matériel après étude morphologique pour techniques ancillaires

L’intérêt de la cytoponction du nodule thyroïdien comme outil efficace de diagnostic et de tri des nodules à opérer a été validé lors de la conférence de consensus international de BETHESDA en 2009 puis révision en 2017, intégrant les nouvelles catégories de tumeurs folliculaires NIFT-P et l’apport des techniques ancillaires pour certaines catégories.
Une classification des lésions en six catégories bien définies précisant le risque de malignité et conduisant à une prise en charge spécifique du patient pour chacune d’entre elle a été proposée.
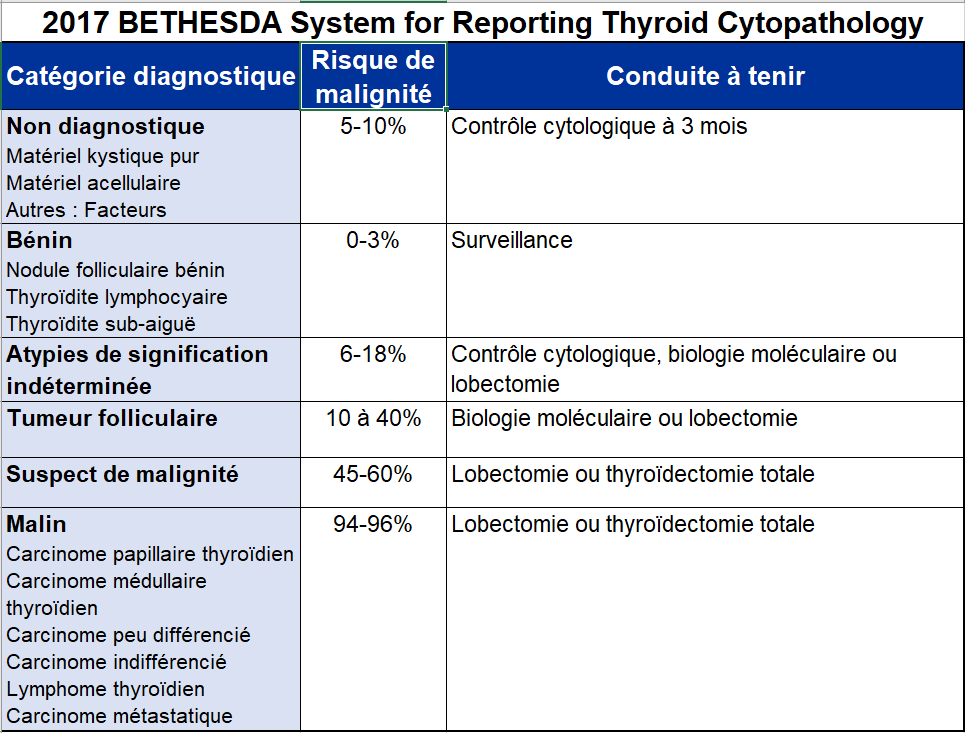
Le cancer de la thyroïde est rare (5% des nodules thyroïdiens ponctionnés).
Le type papillaire est de loin le plus fréquent et est associé à un bon pronostic.
A l’inverse, la grande majorité de ces nodules sont classés dans la catégorie « bénigne » (B) ce qui conduit le plus souvent à la surveillance du patient.
Compte-tenu des performances diagnostiques de la cytoponction, les lésions classées dans la catégorie « maligne » (M) conduisent à leur exérèse chirurgicale avec une concordance diagnostique très élevée.
Le taux de ponction « non diagnostique » (ND) est variable et est en moyenne de 10%, lié principalement au caractère difficilement accessible, vascularisé ou spongieux du nodule.
L’expertise et l’ancienneté de pratique du geste de ponction améliore la qualité du matériel obtenu pour l’analyse cytologique.
Une première cytoponction non diagnostique nécessite un contrôle dans les 3 mois si l’opérateur juge que celui-ci est techniquement réalisable.
Malgré ces performances, environ 30% des cytoponctions de nodules sont classées dans des catégories lésionnelles dites « indéterminée » correspondant aux catégories « atypies de signification indéterminée », « tumeur vésiculaire », et « suspecte de malignité ».
La catégorie « atypie de signification indéterminée » (ASI) correspond à des critères diagnostiques précis et en raison d’un risque de malignité demeurant faible, un nouveau contrôle cytologique dans les 3 mois est recommandé. Cette nouvelle ponction permet de reclasser le nodule dans une catégorie lésionnelle dans plus de 50% des cas, le plus souvent bénigne.
La persistance d’atypies sur un deuxième prélèvement de bonne qualité conduit à la discussion en fonction des données cliniques et échographiques de chirurgie ou analyse complémentaire en biologie moléculaire.
Concernant les « tumeur vésiculaire/oncocytaire » (TF) la recommandation en première ligne est la chirurgie avec expertise anatomopathologique complète de la lésion et de sa capsule à la recherche de signes d’invasion capsulaire définissant alors le caractère malin (10 à 40% des cas).
Dans la catégorie « suspecte de malignité » (SM), il reste encore 40 à 55% de nodules au final bénin après expertise anatomopathologique.
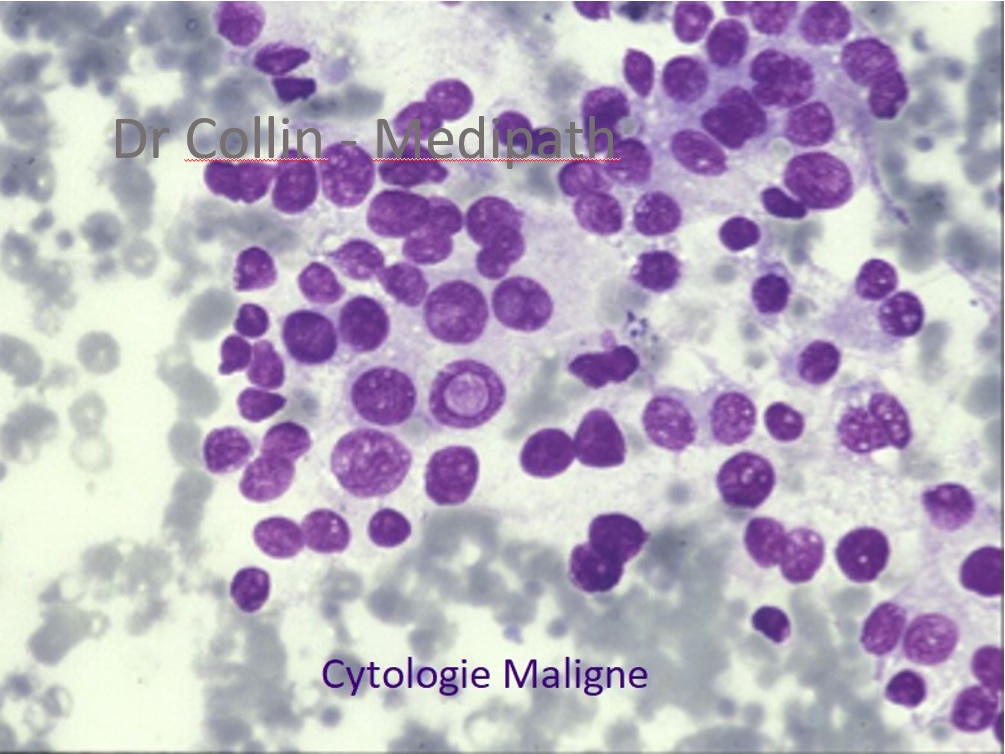
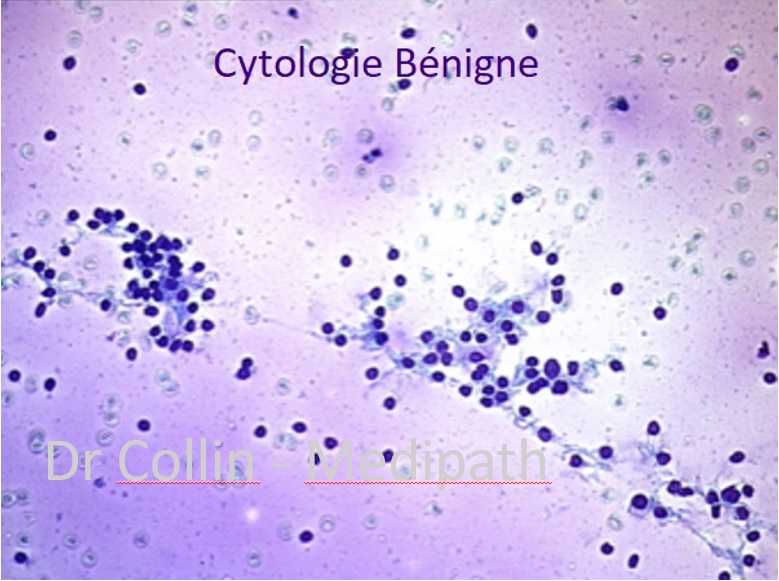
L’analyse de l’expression de certains bio-marqueurs (HBME1, TPO) permettent d’améliorer la performance diagnostique de la cytologie dans les « catégories indéterminées ». L’objectif global reste la sélection des nodules à opérer et à l’inverse limiter le nombre de chirurgie « inutiles »
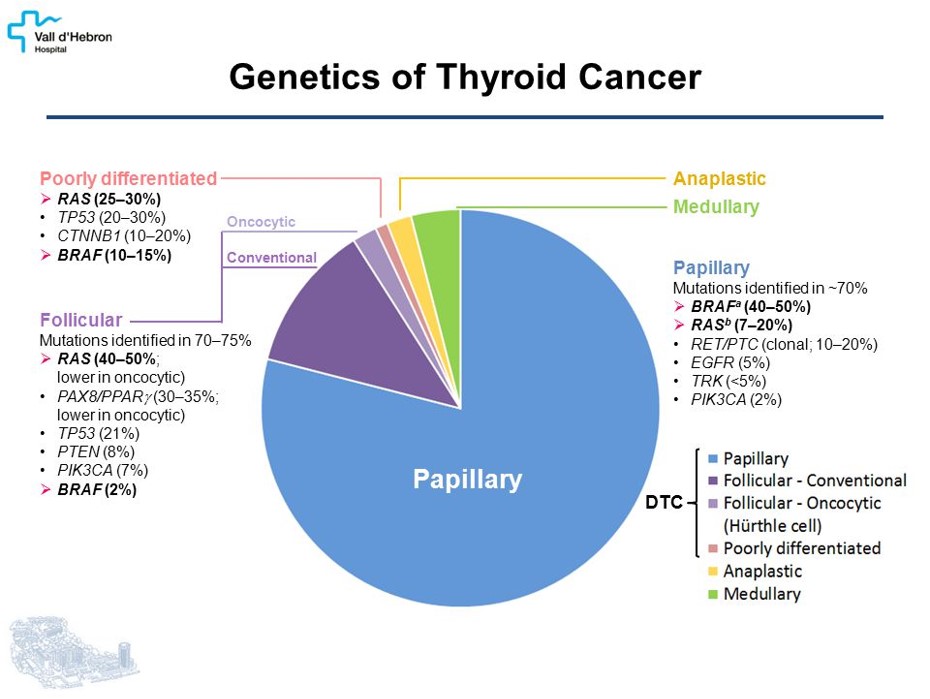
L’étude des mécanismes de cancérogénèse des cancers thyroïdiens de souche folliculaire, (les plus fréquents), a permis de cibler des marqueurs moléculaires permettant de confirmer ou d’exclure la probabilité d’un cancer. Ces marqueurs (en particulier les mutations des gènes BRAF, RAS, RET et les réarrangements de RET/PTC, de PAX8/PPAR et de NTRK) sont utiles pour le diagnostic, mais également pour la prise en charge thérapeutique et le suivi des patients. Les tests commercialisés restent encore coûteux pour notre système de santé mais la détection de ces marqueurs par les techniques de NGS utilisées pour d’autres cancers permet de rechercher ces anomalies, lorsque celles-ci sont jugées nécessaires après discussion pluri-disciplinaire.